医疗器械FDA注册510K介绍:
医疗器械FDA注册FDA 510(K)是向FDA提交的市场前提交的报告,目的是证明所销售的设备至少与不经市场前批准(PMA)的合法销售的装置一样安全和有效。510(K)提交人必须将其设备与一个或多个类似的合法销售装置进行比较,并提出和支持其实质性的等同索赔。

食品和药物管理局(FDA)内的设备和放射健康中心(CDRH)审查和处理了FDA 510(K)提交的医疗设备。在提交人收到宣布设备SE的命令之前,提交人不得继续销售该设备。一旦设备被确定为SE,它就可以在美国市场上销售。SE的测定通常在90天内进行,并且是根据提交者提交的信息进行的。FDA 510(K)不是FDA批准或FDA认证的医疗器械,它只是一个营销许可。FDA不通过510 k程序提供批准或认证,也不颁发注册证书,但您将获得510 k号码。
请注意,FDA没有进行510(K)预放行设施检查.提交者可以在FDA 510(K)批准后立即销售该设备,制造商应在FDA 510(K)批准后随时为FDA质量体系(QSR)检查做好准备。
FDA没有具体说明谁必须申请510(K)。相反,他们指定哪些行动,如向美国市场推出设备,需要FDA 510(K)提交。
什么条件需要做FDA510K注册?
1.国内制造商向美国市场推出一种设备;
完成的设备制造商必须提交FDA 510(K),如果他们根据自己的规格制造设备,并在美国市场上销售。已完成设备的配件出售给最终用户也被认为是成品设备。但是,设备部件的制造商不需要提交510(K),除非这些部件作为替换部件推销给最终用户。
合同制造商,那些根据合同生产设备的公司,根据别人的规格,不需要提交FDA 510(K)。
2.规范开发者向美国市场介绍一种设备;
规范开发人员为已完成的设备开发规范,但该设备由另一家公司或实体根据合同制造,规范开发者提交FDA 510(K)通知,而不是合同制造商。
3.进行标签更改或其操作对设备有重大影响的修理者或再标记者
再包装者或再包装者可能要求FDA 510(K)提交,如果他们显著改变标签或其他影响设备的任何状况,重要的标签更改可能包括修改手册,例如添加新的预期用途、删除或添加警告、禁忌等操作,例如绝育,可能会改变设备的状况。然而,大多数再包装者或再包装者不需要提交510(K)。
4.外国制造商/出口商或外国制造商/出口商的美国代表向美国市场介绍一种设备,也要求提交FDA 510(K)
请注意,所有II类和III类设备的制造商(包括规范开发人员)和选择的第一类设备在其设备开发过程中必须遵循设计控制。510(K)的保持者必须有设计控制文件可供FDA在现场检查时审查。此外,对设备规格或制造工艺的任何更改必须按照质量系统规则(QSR)进行,并可能受到新的510(K)的限制。
华商检测可以帮助您获得FDA 510(K)批准(批准)您的医疗设备;我们的经验丰富的顾问可以为您提供正确的指导,在FDA 510 k提交要求。我们的顾问可以帮助您从谓词设备的选择,通过建立注册和上市。
华商检测为国内外医疗器械制造商提供美国代理服务。
我们的FDA认证服务包括:
1.设备类别、产品代码和规定号的识别
2.测试标准的判定
3.确定510 K试验要求
4.医疗器械标签审查
5.编写510 k文件
6.向FDA提交510 K份文件
7.为510 k提供美国代理服务
8.代表我们的客户与fda沟通
9.准备对FDA问题的澄清
10.协助将510 k审查费转拨给fda
11.通知新的510 k号码
12.协助FDA列出设备清单,包括在FDA 510(K)提交的章节,请注意没有510(K)表格。
医疗器械FDA注册510K服务流程:
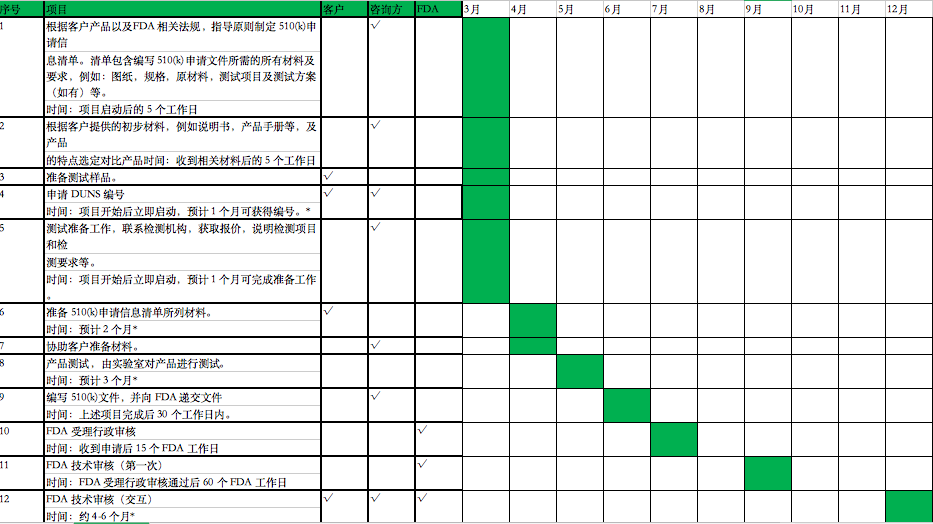
1.根据客户产品以及FDA相关法规,指导原则制定510(k)申请信息清单,清单包含编写510(k)申请文件所需的所有材料及要求,例如:图纸,规格,原材料,测试项目及测试方案(如有)等。
时间:项目启动后的5个工作日
2.根据客户提供的初步材料,例如说明书,产品手册等,及产品的特点选定对比产品
时间:收到相关材料后的5个工作日
3.准备测试样品。时间:约2个月。*
4.申请DUNS编号
时间:项目开始后立即启动,预计1个月可获得编号。*
5.测试准备工作,联系检测机构,获取报价,说明检测项目和检测要求等。
时间:项目开始后立即启动,预计1个月可完成准备工作。
6.准备510(k)申请信息清单所列材料。
时间:预计2个月*
7.协助客户准备材料。
8.产品测试,由实验室对产品进行测试。
时间:预计3个月*
9.编写510(k)文件,并向FDA递交文件
时间:上述项目完成后30个工作日内。
10.FDA受理行政审核
时间:收到申请后15个FDA工作日
11.FDA技术审核(第一次)
时间:FDA受理行政审核通过后60个FDA工作日
12.FDA技术审核(交互)
时间:约4-6个月*
备注:
a:510K主要测试,不同的产品不同的标准,具体以签订合同后我司技术老师确认和提供的清单为准。
b:标注星号之时间为预估时间,仅供参考,不做为任何承诺时间期限。
美国食品及药物管理局医疗设备fda注册申请表:
1.FDA上市前审查提交封面
2.FDA 510(K)申请表
3.FDA 510(K)使用说明
4.FDA 510(K)摘要或FDA 510(K)声明
5.FDA真实和准确声明
6.FDA三级总结与认证
7.财务证明或披露报表
8.FDA合格声明和简要报告
9.FDA 510(K)执行摘要
10.医疗设备描述
11.FDA 510(K)实质性等值讨论
12.拟议标记
13.消毒和货架寿命
14.生物相容性
15.软件
17.电磁兼容与电气安全
18.性能试验.工作台
19.性能测试-动物
20.性能试验.临床
21.其他
点击进入华商检测官网,了解更多认证讯息。

 华商检测认证机构中心
华商检测认证机构中心








