什么是UDI?
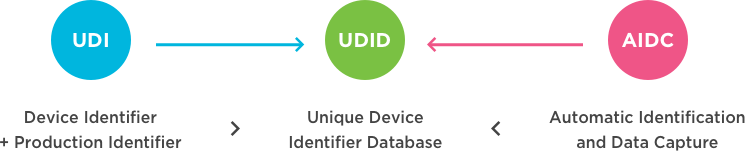
一种独特的设备识别(UDI)系统旨在通过分发和使用提供单一的、全球统一的医疗设备的阳性标识,要求设备的标签必须具有全球唯一的设备标识符(通过使用自动识别和数据捕获,并在适用情况下使用其人类可读的解释),并根据标准提供UDI-DI(设备标识符),该唯一标识符的UDI-DI(设备标识符)也链接到特定管辖权的公共UDI数据库(来源:国际医疗设备监管机构论坛(IMDRF):
这个美国食品和药物管理局(FDA),欧盟委员会其他监管机构也将病人安全作为一项战略优先事项,制定了UDI法规。医疗器械和体外诊断(IVD)装置他们的目标是按照综合发展框架准则协调一致的全球办法.
UDI和GS1
GS1是一个UDI发行机构/实体,基于世界各地的许多法规,特别是美国、欧盟、中国、韩国、沙特阿拉伯,这意味着向这些市场提供受监管的医疗设备的制造商可以使用GS1标准来执行UDI的要求。
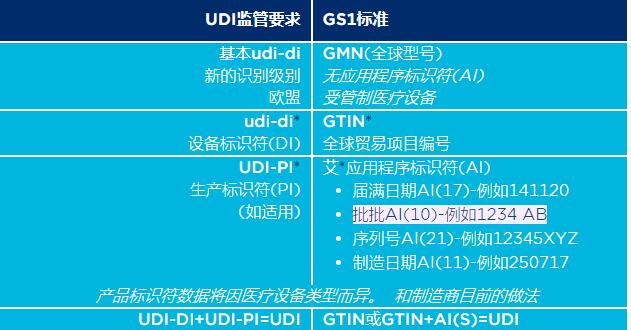
这个GS1标准体系提供一个全球框架来识别、捕获和共享保健产品信息,从而使UDI在全球范围内得到一致的实现。UDI法规要求已转换为GS1标准,如表所示。
GS1成员组织是那些发行GS1公司前缀(GCP)的公司,它支持GS1标识密钥的生成。它们还直接支持GS1标准的使用,以便在全球范围内实现UDI要求。
这个HRI(人类可读信息)格式应遵守.的规则UDI发行实体
美国的UDI
美国食品和药物管理局(FDA)于2013年9月发布aUDI规则它建立了一个UDI系统,适用于美国市场上的所有医疗设备。
2013年12月17日,GS1已通过美国FDA认证。作为唯一设备标识符(UDI)的颁发机构。GS1标准符合美国FDA发放UDI的标准。GS1成员组织将帮助制造商遵守美国FDA UDI法规的要求,以支持病人安全和供应链安全。
受监管的产品数据必须提交给全球唯一设备标识数据库(GUDID),即美国FDA UDI监管数据库。
美国的UDI需求遵守日期可以找到这里。
欧盟的UDI
这个欧盟医疗器械条例(MDR)和体外诊断规则(IVDR)于2017年4月5日通过,确定了欧盟UDI系统的要求。
2019年6月7日,GS1由欧洲联盟委员会指定作为唯一设备标识符(UDI)的颁发实体,GS1标准使来自世界各地的医疗保健制造商能够通过遵守欧盟法规和GS1通用规范.
所需的产品数据将提交给EUDAMED,即欧盟监管医疗设备数据库。
欧盟法规引入了一个新概念:
基本UDI-DI,旨在将受监管的医疗设备归为同一标识符。GS1开发了一个支持基本udi-di实现的新密钥:全局模型号(GMN)。这个GMN发电机工具帮助生成GMN(基本UDI-DI),计算相关的检查字符对或验证您的GMN(基本UDI-DI)。
欧盟中按行为体类型分列的UDI要求的遵守日期和补充信息可在欧盟委员会的网站上查阅。https://ec.europa.eu/growth/sectors/medical-devices/regulatory-framework/getting-ready-new-regulations_en
欧洲联盟委员会正在研究实施细节,并定期开展工作。https://ec.europa.eu/growth/sectors/medical-devices/new-regulations/guidance_en
有用的信息:
欧洲联盟委员会医疗器械网页https://ec.europa.eu/growth/sectors/medical-devices/new-regulations_en
欧盟委员会关于UDI的常见问题https://ec.europa.eu/docsroom/documents/36664
点击进入华商检测官网,了解更多认证讯息。

 华商检测认证机构中心
华商检测认证机构中心








